Neuroblastoma adalah kanker pada anak2 yang paliong umum pada bayi dengan tingkat kejadian 650 kasus baru pertahun di Amerika serikat.Hampir 50% dari kasus neuroblastoma terjadi pada anak2 dibawah 2tahun.Ini adalah neuro endokrin tumor yang timbul dari setiap saraf puncak unsure dari sistim saraf simpatik atau SNS.Paling sering berasal dari salah satu kelenjar adrenal,tetapi dapat juga berkembang dalam jaringan saraf di leher,dada,perut atau panggul.
Neuroblastoma adalah kanker pada sistem saraf yang sering ditemukan pada masa kanak-kanak.
Neuroblastoma bisa tumbuh di berbagai bagian tubuh.
Kanker ini berasal dari jaringan yang membentuk sistem saraf simpatis (bagian dari sistem saraf yang mengatur fungsi tubuh involunter/diluar kehendak, dengan cara meningkatkan denyut jantung dan tekanan darah, mengkerutkan pembuluh darah dan merangsang hormon tertentu).
Neuroblastoma paling sering berasal dari jaringan kelenjar adrenal di perut.
Kanker ini biasanya segera menyebar ke kelenjar getah bening, hati, tulang dan sumsum tulang.
Sekitar 75% kasus ditemukan pada anak yang berumur kurang dari 5 tahun.
Neuroblastoma terjadi pada 1 diantara 100,000 orang dan agak lebih sering menyerang anak laki-laki.
Stadium
1.Tahap 1: lokalisasi tumor terbatas pada daerah asal
2.Tahap 2A : unilateral tumor dengan reseksi bruto tidak lengkap.di infeksi ipsilateral dan kontralateral kelenjar geta bening negatife untuk tumor
3.Tahap 2B : unilateral tumor dengan lenkap atau tidak lenkap dengan kelenjar getah bening ipsilateral tumor positif diidentifikasi kelenjar getah bening kontra lateral negative untuk tumor
4.Tahap 3: tumor terinfiltrasi di garis tengah dengan atau tanpa keterlibatan kelenjar getah bening regional.
5.Tahap 4 :Penyebaran ke kelenjar getah bening,sumsum tulang,hati,dan organ2 yang lain
STUDI KASUS
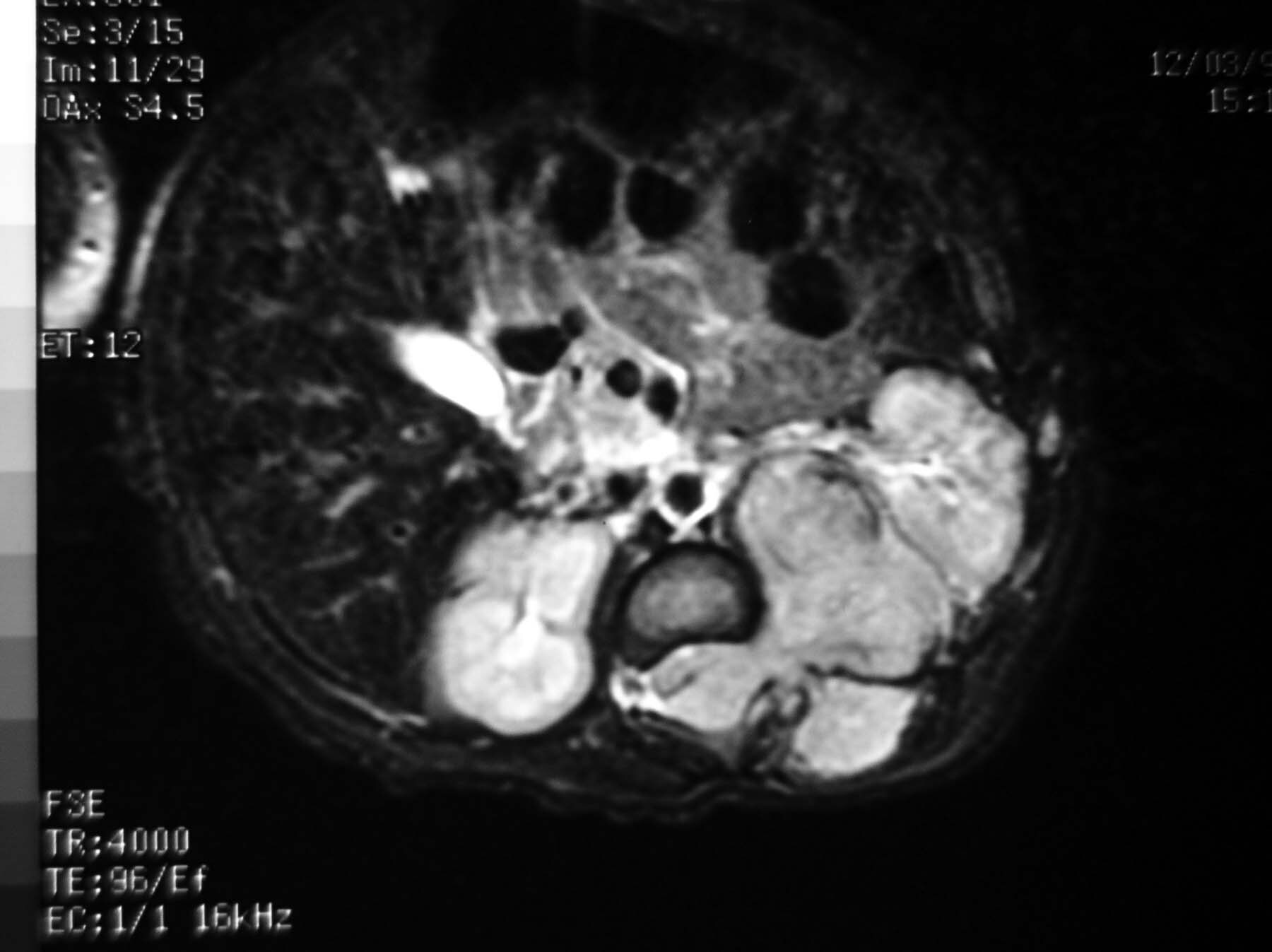
Laki2 bayi 28 hari DD klinis ca caudo pancreas (dari hasil USG)dimintakan konvirmasi pemeriksaan MRI di RS.Spesialis Husada Utama dengan bantuan anastesi.Pasien disipakan untuk puasa minimal 4jam sebelum pemeriksaan.
Teknik pemeriksaan MRI meliputi :
Karena pasien masih bayi BB hanya 1KG kita menggunakan coil : sense flexi M yang biasa dipakai untu MRI Wrist.dengan irisan axial,coronal,sagital T1FSE,T2 Spair FSE dan BFFE dengan menggunkan teknik trigger tanpa dan dengan kontras menunjukkan :
Massa inhomogenous,bulat dengan fat capsul,batas tegas di daerah suprarenal kiri,serta mendesak ke potero-inferior (mencurigakan neuroblastoma)
Jumat, 30 Oktober 2009
Senin, 26 Oktober 2009
Spectroscopic imaging (CSI : Chemical Shift Imaging)
Denis Hoa
15/02/2009 10:27 pm
Metabolic imaging (CSI) consists in recording the spectroscopic data for a group of voxels, in slice(s) (2D) or by volume (3D). It is based on a repetition of STEAM or PRESS type sequences to which is added spatial phase encoding (figure 15.7). The number and direction of phase encodings depend on the number of dimensions explored (1D, 2D or 3D), adding on to acquisition time. The duration of the sequence is equal to TR ∙ Nph1D ∙ Nph2D ∙ Nph3D ∙ NSA (NphxD number of phase encoding steps in direction x).
To reduce acquisition time, variants of the basic sequence have been proposed:
Signal processing calls on Fourier transforms (1 for each phase-encoded dimension phase + 1 for spectral analysis) and requires data correction (correction of the baseline, phase, smoothing truncation artifacts…).
The results appear in the form of parametric images («metabolic maps ») or a matrix of the spectra of the regions to be studied.
link http://www.imaios.com/en/e-Courses/e-MRI/Magnetic-Resonance-Spectroscopy-MRS/spectroscopic-imaging-csi
To reduce acquisition time, variants of the basic sequence have been proposed:
- Multiple Slice CSI accelerates the acquisition of several slices compared to 2D CSI
- Turbo CSI (several echoes received by rewinding the phase encoding gradient before each additional echo, derived from the repetition of the last spin echo pulse and the gradient)
- Fast CSI provides an important speed gain compared to 2D CSI, by performing spatial encoding in one direction during signal acquisition, by means of oscillating gradients, similar to spatial encoding in an echo planar sequence. These techniques are less sensitive than the classic CSI sequence. The speed gain is particularly useful in 3D spectroscopic imaging or in the case of motion artifacts.
- CSI with parallel acquisition (SENSE CSI).
Signal processing calls on Fourier transforms (1 for each phase-encoded dimension phase + 1 for spectral analysis) and requires data correction (correction of the baseline, phase, smoothing truncation artifacts…).
The results appear in the form of parametric images («metabolic maps ») or a matrix of the spectra of the regions to be studied.
link http://www.imaios.com/en/e-Courses/e-MRI/Magnetic-Resonance-Spectroscopy-MRS/spectroscopic-imaging-csi
Single voxel spectroscopy (SVS)
Denis Hoa
15/02/2009 10:27 pm
In SVS, the signal is received of a volume limited to a single voxel. This acquisition is fairly fast (1 to 3 minutes) and a spectrum is easily obtained. It is performed in three steps:
Techniques applying a 180° inversion pulse with adapted TI, like those used in FLAIR and STIR sequences, can also be used to eliminate the water signal (WEFT: Water Elimination Fourier Transform) or suppress the fat signal in breast spectroscopy, for example. In practice, CHESS is more commonly used than WEFT.
The three voxel-selection RF pulses have flip angles of 90°. The stimulated echo is recorded from the cumulated effect of the three pulses, thus corresponding to the signal from the only voxel of interest (cf. chapter 6.7.2. Hahn echo and stimulated echo). The TE of the stimulated echo corresponds to double the time interval between the first two pulses. The delay between the second and third RF pulses is the mix time TM. This technique is particularly adapted to short TE spectral acquisitions.
In the PRESS method, the RF pulses have flip angles of 90° - 180° - 180°. The signal emitted by the voxel of interest is thus a spin echo. The amplitude of this spin echo is two times greater than the stimulated echo obtained by STEAM. The PRESS technique thus offers a better signal-to-noise ratio than STEAM. It can be used with short TE (15 – 20 ms) or long TE (135 – 270 ms).
Whatever the case spectroscopic signal recording does not use a frequency encoding readout gradient, as the frequency is used to constitute the spectrum (rather than the position), after Fourier transform of the signal.
link http://www.imaios.com/en/e-Courses/e-MRI/Magnetic-Resonance-Spectroscopy-MRS/single-voxel-spectroscopy
- Suppression of the water signal: the quantity of hydrogen nuclei in the water molecules in the human body is such that the water peak at 4.7 ppm “drowns” and masks the spectroscopic signal from the other metabolites. It is therefore vital to suppress the water peak to observe the metabolites of interest.
- Selection of the voxel of interest
- Acquisition of the spectrum, for which two types of sequence are available (PRESS: Point-RESolved Spectroscopy, STEAM: STimulated Echo Acquisition Mode)
Water signal suppresion
The most commonly used method to suppress the water peak is CHESS (CHEmical Shift Selective). CHESS consists in applying three couples (90° RF pulses + dephasing gradients) in each spatial direction. The bandwidth of these RF pulses is narrow and centered on the resonance frequency of the water peak in order to saturate the water signal and preserve the signal from the other metabolites.Techniques applying a 180° inversion pulse with adapted TI, like those used in FLAIR and STIR sequences, can also be used to eliminate the water signal (WEFT: Water Elimination Fourier Transform) or suppress the fat signal in breast spectroscopy, for example. In practice, CHESS is more commonly used than WEFT.
Principles of volume selection
The analyzed volume is selected by a succession of three selective radiofrequency pulses (accompanied by gradients) in the three directions in space. These pulses determine three orthogonal planes whose intersection corresponds to the volume studied. Only the signal of this voxel will be recorded, by selecting only the echo resulting from the series of three radiofrequency pulses.PRESS and STEAM sequences
Acquisition of the signal from the selected voxel can be performed using two different types of sequence (figure 15.6):STEAM (Stimulated Echo Acquisition Mode)
The three voxel-selection RF pulses have flip angles of 90°. The stimulated echo is recorded from the cumulated effect of the three pulses, thus corresponding to the signal from the only voxel of interest (cf. chapter 6.7.2. Hahn echo and stimulated echo). The TE of the stimulated echo corresponds to double the time interval between the first two pulses. The delay between the second and third RF pulses is the mix time TM. This technique is particularly adapted to short TE spectral acquisitions.
PRESS (Point RESolved Spectroscopy)
In the PRESS method, the RF pulses have flip angles of 90° - 180° - 180°. The signal emitted by the voxel of interest is thus a spin echo. The amplitude of this spin echo is two times greater than the stimulated echo obtained by STEAM. The PRESS technique thus offers a better signal-to-noise ratio than STEAM. It can be used with short TE (15 – 20 ms) or long TE (135 – 270 ms).
Whatever the case spectroscopic signal recording does not use a frequency encoding readout gradient, as the frequency is used to constitute the spectrum (rather than the position), after Fourier transform of the signal.
link http://www.imaios.com/en/e-Courses/e-MRI/Magnetic-Resonance-Spectroscopy-MRS/single-voxel-spectroscopy
FUNDAMENTALS OF MR SPECTROSCOPY
John R. Hesselink, MD, FACR
link http://spinwarp.ucsd.edu/NeuroWeb/Text/mrs-TXT.htm
MR spectroscopy provides a measure of brain chemistry. The most common nuclei that are used are 1H (proton), 23Na (sodium), 31P (phosphorus). Proton spectroscopy is easier to perform and provides much higher signal-to-noise than either sodium or phosphorus. Proton MRS can be performed within 10-15 minutes and can be added on to conventional MR imaging protocols. It can be used to serially monitor biochemical changes in tumors, stroke, epilepsy, metabolic disorders, infections, and neurodegenerative diseases.� The MR spectra do not come labeled with diagnoses. They require interpretation and should always be correlated with the MR images before making a final diagnosis.
BASIC PHYSICAL PRINCIPLES
The resonant frequencies of nuclei are at the lower end of the electromagnetic spectrum between FM radio and radar. The resonant frequencies of protons range between about 10 MHz at 0.3 T to about 300 MHz on a 7 T magnet. The advantages of higher field strength are higher signal-to-noise and better separation of the metabolite peaks. In a proton spectrum at 1.5 T, the metabolites are spread out between 63,000,000 and 64,000,000 Hertz. Rather than use these large numbers, some very smart person decided to express the resonant frequencies in parts per million (ppm), and he/she positioned NAA at 2.0 ppm and let the other metabolites fall into their proper positions on the spectral line. Then, for unknown reasons, he/she reversed the ppm scale so that it reads from right to left. 

For MR imaging, the total signal from all the protons in each voxel is used to make the image. If all the signal were used for MRS, the fat and water peaks would be huge and scaling would make the other metabolite peaks invisible. Since we aren't interested in fat and water anyway, the fat and water are eliminated. Fat is avoided by placing the voxel for MRS within the brain, away from the fat in bone marrow and scalp. Water suppression is accomplished with either a CHESS (CHEmical-Shift Selective ) or IR (Inversion Recovery) technique. These suppression techniques are used with a STEAM or PRESS pulse sequence acquisition. A Fourier transform is then applied to the data to separate the signal into individual frequencies. Protons in different molecules resonate at slightly different frequencies because the local electron cloud affects the magnetic field experienced by the proton.
The STEAM (STimulated Echo Acquisition Mode) pulse sequence uses a 90o refocusing pulse to collect the signal like a gradient echo. STEAM can achieve shorter echo times but at the expense of less signal-to-noise. The PRESS (Point REsolved SpectroScopy) sequence refocuses the spins with a 180o rf pulse like a spin echo. Two other acronyms require definition. CSI (Chemical Shift Imaging) refers to multi-voxel MRS. SI (Spectroscopic Imaging) displays the data as an image with the signal intensity representing the concentration of a particular metabolite.�
As in MR imaging, the echo time affects the information obtained with MRS. With a short TE of 30 msec, metabolites with both short and long T2 relaxation times are observed. With a long TE of 270 msec, only metabolites with a long T2 are seen, producing a spectrum with primarily NAA, creatine, and choline. One other helpful TE is 144 msec because it inverts lactate at 1.3 ppm.
As a general rule, the single voxel, short TE technique is used to make the initial diagnosis, because the signal-to-noise is high and all metabolites are represented.� Multi-voxel, long TE techniques are used to further characterize different regions of a mass and to assess brain parenchyma around or adjacent to the mass. Multi-voxel, long TE techniques are also used to assess response to therapy and to search for tumor recurrence.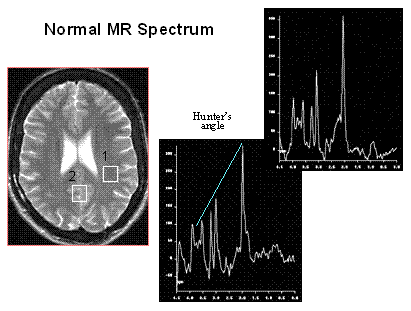

The brain metabolites that are commonly seen on the MR spectrum are listed on the right. Each metabolite appears at a specific ppm, and each one reflects specific cellular and biochemical processes. NAA is a neuronal marker and decreases with any disease that adversely affects neuronal integ-rity. Creatine provides a measure of energy stores. Choline is a measure of increased cellular turnover and is elevated in tumors and inflammatory processes. The observable MR metabolites provide powerful information, but unfortunately, many notable metabolites are not represented in brain MR spectra. DNA, RNA, most proteins, enzymes, and phospholipids are missing. Some key neurotransmitters, such as acetylcholine, dopamine, and serotonin, are absent. Either their concentrations are too low, or the molecules are invisible to MRS.
Normal MR spectra obtained from gray matter and white matter are shown on the right. The predominant metabolites, displayed from right to left, are NAA, creatine, choline, and myo-inositol. The primary difference between the two spectra is that gray matter has more creatine.� Hunter's angle is the line formed by the metabolites on the white matter spectrum. The common way to analyze clinical spectra is to look at metabolite ratios, namely NAA/Cr, NAA/Cho, and Cho/Cr. Normal and abnormal values are shown in the chart to the right. By including a known reference solution when acquiring the MR spectral data, absolute concentrations of metabolites can be calculated.
CLINICAL APPLICATIONS

Brain Tumors
MRS can be used to determine the degree of malignancy. As a general rule, as malignancy increases, NAA and creatine decrease, and choline, lactate, and lipids increase. NAA decreases as tumor growth displaces or destroys neurons.� Very malig-nant tumors have high metabolic activity and deplete the energy stores, resulting in reduced creatine.� Very hypercellular tumors with rapid growth elevate the choline levels. Lipids are found in necrotic portions of tumors, and lactate appears when tumors outgrow their blood supply and start utilizing anaerobic glycolysis. To get an accurate assessment of the tumor chemistry, the spectroscopic voxel should be placed over an enhancing region of the tumor, avoiding areas of necrosis, hemorrhage, calcification, or cysts.
Multi-voxel spectroscopy is best to detect infiltration of malignant cells beyond the enhancing margins of tumors. Particularly in the case of cerebral glioma, elevated choline levels are frequently detected in edematous regions of the brain outside the enhancing mass.� Finally, MRS can direct the surgeon to the most metabolically active part of the tumor for biopsy to obtain accurate grading of the malignancy.
A common clinical problem is distinguishing tumor recurrence from radiation effects several months following surgery and radiation therapy. Elevated choline is a marker for recurrent tumor. Radiation change generally exhibits low NAA, creatine, and choline on spectroscopy. If radiation necrosis is present, the spectrum may reveal elevated lipids and lactate.
MRS cannot always distinguish primary and secondary tumors of the brain from one another. As mentioned above, one key feature of gliomas is elevated choline beyond the margin of enhancement due to infiltration of tumor into the adjacent brain tissue. Most non-glial tumors have little or no NAA. Elevated alanine at 1.48 ppm is a signature of meningiomas.� They also have no NAA, very low creatine, and elevated glutamates.
Cerebral Ischemia and Infarction
When the brain becomes ischemic, it switches to anaerobic glycolysis and lactate accumulates.� Markedly elevated lactate is the key spectroscopic feature of cerebral hypoxia and ischemia. Choline is elevated, and NAA and creatine are reduced.� If cerebral infarction ensues, lipids increase.
Trauma
MR spectroscopy is not routinely used in the acute setting of head injuries. CT and MR imaging demonstrate the fractures and intracranial hemorrhage that require emergent surgical intervention. On the other hand, when the patient has stabilized, MRS is helpful to assess the degree of neuronal injury and predict patient outcomes. Especially in the case of diffuse axonal injury, imaging often underestimates the degree of brain damage. Clinical outcome correlates inversely with the NAA/Cr ratio. The presence of any lactate or lipid indicates a worse prognosis.
Infectious Diseases
As in the case of non-glial tumors, brain abscesses destroy or displace brain tissue, so NAA is not present. The voxel should include the abscess cavity to detect the breakdown products of these lesions. Lactate, cytosolic acid, alanine, and acetate are characteristic metabolites in bacterial abscesses. Toxoplasmosis and tuberculomas show prominent peaks from lactate and lipids.
Clinical investigators of HIV infection and AIDS have been very interested in the potential of MRS for measuring the effects of HIV infection on the brain and neuro-cognitive function. Unfortunately, MRS has not proven very sensitive for detecting HIV encephalitis in the early stages of infection. On the other hand when patients start developing neurocognitive deficits and AIDS dementia complex, the MR spectra become positive, namely with elevated choline and reduced NAA. Choline is the best marker for the white matter abnormalities, and the extent of NAA depletion correlates directly with the degree of dementia. MRS is also very helpful in following patients and assessing the effects of anti-viral therapies.
There is also considerable interest in using MRS to distinguish the common focal brain lesions in AIDS patients. The most helpful marker is choline, which is elevated in lymphoma, but low or absent in toxoplasmosis, tuberuloma, and cryptococcoma. Toxoplasmosis is characterized by markedly increased lactate and lipids and depletion of normal brain metabolites. Tuberculoma and cryptococcoma are similar but with relatively little lactate. The spectrum for PML may be similar to lymphoma, but the imaging features are distinctly different and PML may have elevated myo-inositol.
Pediatric Metabolic Disorders
MRS has a very important role in diagnosing and monitoring patients with metabolic disorders.This group includes a long list of diseases that affect the gray and white matter to varying degrees. The names and terminologies of these disorders are confusing because they were derived from the pathologic literature before their metabolic defects were discovered. As the specific biochemical and enzyme defects are being elucidated, these diseases are being classified more appropriately. The list of disorders is long and beyond the scope of this syllabus.� Some of the more important diseases are listed below, along with their specific metabolic markers on MR spectra.
Since most metabolic disorders present in infancy, it is important to understand the normal pediatric MR spectrum. Compared to the adult, newborns have much less NAA, and increased choline and myo-inositol. Progression to the adult pattern follows myelination.

Minggu, 25 Oktober 2009
Aplikasi Kontras Media Pada MRI
Pendahuluan
Paramagnetik kontras
- MRI menggunakan medan magnet
- Diferensiasi jaringan lunak sangat baik
- Kontras meningkatkan nilai diagnostik dan memperlihatkan detai kelainan morfologi
- Kontras negatif:CO2 dan udara
- Kontras positif : Barium,yodium intravaskuler
- Microbubles untuk pemeriksaan USG
- Invitro : Bloch,Hansen dan Packard tahun 1946
- Pemberian ferum nitrit memperpendek waktu relaksasi T1
- Dilanjutkan Bloembergen dan Solomon
- Penggunaan Kontras dengan MRI pertama kali oleh Lauterbur,Mendoca,Diaz dan Rudin (1978)
- Penggunaan pada manusia pertama kali menggunakan Gadolinium DTPA (Magnevist)
- Penelitian lanjutan : kontras cukup aman dapat ditolerensi ordan
- Mempengaruhi waktu relaksasi proton T1 dan T2
- Sinyal akan berbeda
- Paramagnetik
- Superparamagnetik
- Paramagnetik Gadolinium,Chromium,Mangan,Nikel
Paramagnetik kontras
- Sifat kontras : larut dalam air
- Diekskresi ginjal 3 jam (75%)24 jam (100%)
- Dapat digunakan untuk kasus insufisiensi renal
- Dosis 0.1-0.2 mmol/Kg BB
- Lethal Dose :8 mmol/KgBB
- Menyala pada TiW
- Efek samping kadang2 sakit kepala,mual,rasa panas
- Bentuk suspensi
- Setelah melalui vaskuler terjadi efek fagosit
- nama dagang : Resovist (Schering) dan Endoderm (Guerbet)
- Tumor
- Infeksi
- Lain2 Demielinasi,MRA
- Kontras khusus
- Label antibody
- Melihat keganasan
- Metastase tumor
- Infark miokard
- Kontras meningkatkan nilai diagnosa
- Memperpendek waktu relaksasi T1 dan T2
- Jenis kontras yang umum : Gadolinium
- Dosis 0,1-0,2 mmol/KgBB
Sabtu, 24 Oktober 2009
Tumor Buli Ditinjau Dari Aspek Radiologi
PENDAHULUAN
Tumor ganas kandung kemih sekitar 90% adalah karsinoma sel transisional dan 10% adalah ca skuamosa dan jarang sekali adenokarsinoma yang berasal dari jaringan urakus. Didaerah sistoma dapat menyebabkan kanker skuamosa. Kanker kandung kemih dapat kapiler, noduler, ulseratif atau infiltratif. Derajat keganasan ditentukan oleh tingkat deferensiasi dan penetrasi ke dalam dinding atau jaringan sekitar kandung kemih. Epitel transisional terdiri dari 4-7 lapisan sel epitel ketebalan lapisan tergantung dari tingkat distensi kandung kemih. Adapun yang berperan dalam maslah ini adalah sel basal, sel intermediate, sel superficial, inilah yang akan menutupi sel intermediate, bergantung pada apakah kandung kemih dalam keadaan distensi atau tidak.
FAKTOR RESIKO
Factor resiko untuk kanker kemih mencakup karsinogen dalam lingkungan kerja, seperti bahan pewarna, karet, bahan kulit, tinta atau cat. Factor resiko lainnya adalah infeksi bakteri kambuhan atau kronis pada saluran kemih dan kebiasan merokok. Ca kandung kemih dua kali lebih banyak menyerang perokok daripada yang bukan perokok. Disamping itu, terdapat kemungkinan hubungan antara kebiasaan minum kopi dan Ca kandung kemih. Skistasambrosisi kronik (infeksi parasit yang mengiritasi kandung kemih) juga merupakan factor resiko. Kanker yang tumbuh dari kelenjar prostate, kolon serta rectum pada laki-laki dan dari traktus ginkologis bawah pada wanita dapat bermetastase di kandung kemih.
MANIFESTASI KLINIS
Tumor ini biasanya muncul dari basic vesica urinaria dan meliputi urivisium eretra serta kolumna vesica urinaria. Hematuria berat dan tanpa nyeri adalah gejala kandug kemih yang paling sering ditemukan. ISK merupakan komplikasi yang lazim terjadi dan menyebabkan gejala berkemih yang sering, urgensi dan disuria. Namun demikian, setiap perubahan pada urinasi didaerah panggul atau punggung dapat terjadi pada metastasis kanker tersebut.
PEMERIKSAAN DIAGNOSTIK
Tidak ada tes screening dini yang akurat untuk menemukan penyakit ini, namun dapat dilakukan sitologi urine untuk melihat adanya sel kanker. Lavase kandung kmih dengan salin mungkin akurat. Aliran sitometri dari urine untuk memeriksa ploidi DNA. Pielogram IV untuk mengevaluasi traktus urinarius bagian atas dan pengisian kandung kemih. Biopsy pada daerah yang dicurigai.
PENATALAKSANAAN
Factor-faktor yang mempengaruhi rencana pengobatan mliputi jenis tumor, kedalam invasi tumor dalam kandung kemih, penyebaran penyakit, dan keadan umum klien. Factor-faktor tersebut penting dalam rencana perawatan klien. Reseksi transurethral (TUR) dan vulgrasi digunakan pada karsinoma insitu atau untuk lesi permukaan yang kecil. Karena kecepatan kambuhnya tinggi, kemoterapi intravesikal atau immunoterapi mungkin dianjurkan. Tiopeta, mitomicin, dan doksorubinsin adalah agen yang telah digunakan untuk pengobatan intravesikal. Terapi laser juga sebuah terapi yang mungkin untuk klien dengan lesi kecil. Reseksi kandung kemih segmental digunakan untuk tumor besar dan tunggal pada puncak kandung kemih atau dinding laterala atau untuk adenokarsinoma.
Ketika tumor itu incasif atau tidak dapat ditangani atau dikontrol dengan pendekatan yang konservatif, sistektomi adalah pengobatan pilihan. Sistektomi sederhana pada seorang pria meliputi pengangkatan kandung kemih, prostate dan vesicaurinaria; sedangkan pada seorang wanita meliputi pengangkatan kandung kemih dan uretra. Iversi urinarius setelah sistektomi dapat dicapai dengan menggunakan sebuah segmen ileum untuk membentuk sebuah salauran antara ureter dan abdomen eksternal. Pilihan lain bagi klien mungkin pembentukan reservoir ileum kontinen yang tidak membutuhkan apparatus penampungan eksternal.
Terapi radiasi untuk kanker kandung kemih sebagai modalitas penatalaksanaan tunggal, untuk penyakit invasive yang mempeunyai kemungkinan sembuh rta-rata 16-30%, ini lebih rendah daripada penatalaksanaan sistektomi, tetapi radiasi dapat digunakan pada klien yang tidak ditangani dengan pembedahan. Tidak ada regimen kemoterapi pasti yang telah dianjurkan untuk pengobatan kanker kemih tahap lanjut.
KOMPLIKASI
Komplikasi pembedhan meliputi peredaran dan infeksi, efek samping dari radiasi dapat menimbulkan striktur pada ureter, uretra, atau kolon. Komplikasi lain dikaitkan dengan daerah metastase penyakit.
ASUHAN KEPERAWATAN
PENGKAJIAN
Manifestasi klinis
Hematuria
Frekuensi berkemih
Disuria
Pemeriksaan diagnostic
Sitologi urine — sel kanker
Cuci kandung kemih — sel kanker
Aliran sitometri urine — ploidi DNA
Pielogram intravena (IVP) — evaluasi traktus urinarius atas & pengisian kandung kemih
Sitoskopi — melihat bagiandalam organ
Biopsy
Ultrasound transurethral — luasnya penyakit
CT-Scan — identifikasi nodus limfe regional dan metastase pulmonal
MRI — luas tumor dan terkenanya nodus limfe
DIAGNOSA KEPERAWATAN & INTERVENSI
1.Perubahan eliminasi urine dan kerusakan integritas kulit R/T pembuatan saluran luar abdominal untuk urine.
Kriteria Evaluasi : berpartisipasi dalam aktivitas yang b/d perawatan ileostomi
Intervensi perawatan Ostomi :
Pasang alat ostomi yan tepat ukuran
R/ mencegah iritasi pada kulit daerah sekitar ostomi
Bantu pasien melakukan perawatan ostomi secara mandiri
R/ mengembangkan teknik yang benar
Pantau proses penyembuhan luka insisi pada ostomi
R/ mengembangkan intervensi dini terhadap kemungkinan komplikasi
Anjurkan klien mengunjungi seseorang yang telah mengalami ostomi
R/ menurunkan nasietas dan ketakutan thd kemampuan beradaptasi
Ganti kantung ostomi sesuai kebutuhan
R/ memberi kesempatan dan penguatan terhadap prosedur mengganti
kantong & mengevaluasi stoma
2.Resiko infeksi R/T pembedahan unuk eliminasi urine
Kriteria Evaluasi : tidak ada infeksi pada saluran kemih
Intervensi :
Gunakan sabun antimicrobial untuk cuci tangan
R/ mencegah transmisi organisme
Pertahankan intake cairan adekuat
R/ meningkatkan aliran urine
Ajarkan klien cuci tangan
R/ memberikan informai ttg personal hygiene
Ajarkan klien ttg gejala dan tanda infeksi serta anjurkan untuk melaporkannya
R/ memberikan info untuk meningkatkan kepatuhan
Ajarkan klien dan keluarga untuk sering mengalirkan kantong untuk mencegah refluks
R/ dapat mencegah infeksi
3.Kurang pengetahuan R/T kemoterapi dan imunoterapi
Kriteria Evaluasi : klien mengungkapkan jadwal pengobatan & tujuannya
Intervensi :
Ajarkan klien dan klg prosedur dan tujuan terapi
R/ meningkatkan pemahaman dan menurunkan ansietas
Gunakan teknik steril dalam kateterisasi
R/ mencegah infeksi
Instruksikan klien untuk berkemih sebelum obat dimasukkan
R/ meningkatkan retensi obat
Instruksikan untuk selalu mengubah posisi
R/ meningkatkan lapisan bagian dalm k.kemih dengan obat-obatan
Instruksikan untuk menunggu berkemih selama beberapa jam
R/ memberikan kontak yang besar dari obat dgn permukan k.kemih
Instruksikan klien untuk toileting dengan hati-hati
R/ mencegah pemajanan pada kemoterapi &imunoterapi yg dikeluarkan
Melalui urine
4.Gangguan citra tubuh R/Y diversi urinarius
Kriteria Evaluasi : citra diri meningkat, terpelihara dan terjaga
Intervensi :
Anjurkan klien utnuk mengungkapkan perasaan mengenai ostomi dan Ca kandung kemih dan dampak yg diharapkan pada gaya hidup
R/ meningkatkan integrasi dari perubahan ke dalam gaya tubuh
Evaluasi perasaan klien mengenai diversi urinarius & efeknya, identitas seksual, hubungan dan citra diri
R/ sebagai data untuk merumuskan rencana askep
Bantu untuk memisahkan penampilan fisik dan perasaan kesehatan
R/ meningkatkan citra diri
Berikan kesempatan untuk berduka atas kehilangan fx k.kemih
R/ memberi waktu untuk mengatasi kehilangan
Izinkan klien untuk ventilasi emosi seperti marah dan rasa bersalah
R/ meningkatkan koping
Pantau apakah klien dapat melihat ostominya
R/ ketidakmampuan memandang ostominya mengindikasikan kesulitan koping.
DIarsipkan di bawah: 9. UROLOGY ZONE
Selasa, 13 Oktober 2009
Stagging Ca Prostat
Kanker prostat adalah penyakit kanker yang berkembang di prostat, sebuah kelenjar dalam sistem reproduksi lelaki. Hal ini terjadi ketika sel prostat mengalami mutasi dan mulai berkembang di luar kendali. Sel ini dapat menyebar secara metastasis dari prostat ke bagian tubuh lainnya, terutama tulang dan lymph node. Kanker prostat dapa menimbulkan rasa sakit, kesulitan buang air kecil, disfungsi erektil dan gejala lainnya.
Jumlah kanker prostat sangat bervariasi di dunia. Namun jarang terjadi di Asia Timur dan Selatan; sering terjadi di Eropa dan Amerika Serikat.[1] Menurut American Cancer Society, kanker prostat paling jarang di pria Asia dan paling sering terjadi di orang hitam, dan orang Eropa di tengahnya.[2]
Staging kanker prostat
1.Staging I
Kelenjar yang ada dalam prostat yang tidak dapat dirasakan yang bisanya tidak teraba saat pemeriksaan fisik dan tidak menimbulkan gejala.Hal ini biasanya ditemukan tidak sengaja karena tes darah menunjukkan peningkatan Antigen prostat khusus(PSA)
2.Staging II
Kanker yang biasanya ditemukan oleh biopsy karena adanya peningktan antigen prostat khusus (PSA) atau kanker yang dapat dirasakan pada kelenjar prostat selama pemeriksaan rectal
3.Staging III
Sel sel kanker telah menyebar ke bagian sekitar prostat tetapi tidak menyebar ke kelenjar getah bening
4.Staging IV
Sel sel kanker telahmenyebar ke kelenjar getah bening.
Staging kanker prostat adalahproses yang mengkatagorikan penyebaran kanker diluar prostatatau dengan kata lain probabilitas disembuhkan denga pembedahan atau radiasi.Setelah pasien di tempatkan pada stadium prognosis.kalsifikasi prognostic dapat didasarkan pada pemeriksaan fisik studi pencitraan dan tes darah atau berdasarkan luasnya penyebaran penyakitnya
Ada skema yang bias menjadi acuan untuk melihat staging kanker prostat yang paling umum yang dikeluarkan oleh America join committee on cancerdan dikenal TNM system yang mengevaluasi ukuran tumor, tingkat yang terlibat kelenjar getah bening dan setiap metastase.
Tahap I : Ditemukan secara kebetulan seperti hypertrophy jinak
TNM stadium
Evaluasi tumor (T)
TX : tidak bias mengevaluasi tumor utama
TO :Tidak ada bukti tumor
T1 : Tumor ada,tetapi tidak dapat dideteksi dengan pencitraan
T1a :Tumor yang dikebetulan diketemukan dalam waktu kurang dari 5% dar jaringan prostat resectal
T1b : Tumor yang kebetulan ditemukan lebih dari 5% dari jaringan prostat resectal
T1c : Tumor ditemukan pada biopsy dilakukan karena adanya peningkatan PSA
T2 : Tumor dapat dirasakan atau diraba (diperiksa secara fisik )tapi belum meyebar diluar prostat
T2a:Tumor ada setengah atau kurang dari setengahdari salah satu kelenjar prostat dua lobus
T2b:Tumor lebih dari setengah satu lobus,tapi tidak keduanya
T2c:tumor adalah dalam kedua lobus
T3 : Tumor mulai menyebar melalui prostat kapsul
T3a:Tumor mulai menyebar melalui kapsul pada sah satu atau keduasisinya
T3b:Tumor telah menyerang vesica seminalis
T4:Tumor telah menginvasi ke jaringan yang lain
Evaluasi dari kelenjar getah bening (N)
NX : Tidak dapat mengevaluasi kelenjar getah bening regional
NO:Tidak ada penyebaran di getah bening regional
N1:Telah menyebar ke getah bening regional
Evaluasi metastase (M)
MX: Tidak bias mengevaluasi metastase
MO:Tidak ada metastase
M1:PTerdapat metastase jauh
M1a:Kanker telah menyebar ke kelenjar getah bening
M1b:Kanker telah mneyebar ke tulang
M1c:Kanker telah mnetebar ke organ yang lain
Evaluasi hystologi Grade (G)
GX : Tidak bias dinilai
G1:Tumor mirip jaringan normal (Gleason 2-4))
G2:Tumor agak meyerupai jaringan normal (Gleason 5-6)
G3-4:Tumor hamper tidak meyerupai jaringan normal (Gleason 7-10)
Dalam beberpa tahun terakhir patologi jarang menetapkan kelas tumorkurang dari 3.terutama di jaringan biopsy
Gleason 3 +3 : Tumor grade rendah
Gleason 3 +4/3 +5 : Bebrepa grade rendah dengan kelas tinggi
Gleason 4 +3/5 +3:Biasanya grade tinggi dengan kelas rendah
Gleason 4 +4/4 +5/5 +5 :Semua grade tinggi
Jumlah kanker prostat sangat bervariasi di dunia. Namun jarang terjadi di Asia Timur dan Selatan; sering terjadi di Eropa dan Amerika Serikat.[1] Menurut American Cancer Society, kanker prostat paling jarang di pria Asia dan paling sering terjadi di orang hitam, dan orang Eropa di tengahnya.[2]
Staging kanker prostat
1.Staging I
Kelenjar yang ada dalam prostat yang tidak dapat dirasakan yang bisanya tidak teraba saat pemeriksaan fisik dan tidak menimbulkan gejala.Hal ini biasanya ditemukan tidak sengaja karena tes darah menunjukkan peningkatan Antigen prostat khusus(PSA)
2.Staging II
Kanker yang biasanya ditemukan oleh biopsy karena adanya peningktan antigen prostat khusus (PSA) atau kanker yang dapat dirasakan pada kelenjar prostat selama pemeriksaan rectal
3.Staging III
Sel sel kanker telah menyebar ke bagian sekitar prostat tetapi tidak menyebar ke kelenjar getah bening
4.Staging IV
Sel sel kanker telahmenyebar ke kelenjar getah bening.
Staging kanker prostat adalahproses yang mengkatagorikan penyebaran kanker diluar prostatatau dengan kata lain probabilitas disembuhkan denga pembedahan atau radiasi.Setelah pasien di tempatkan pada stadium prognosis.kalsifikasi prognostic dapat didasarkan pada pemeriksaan fisik studi pencitraan dan tes darah atau berdasarkan luasnya penyebaran penyakitnya
Ada skema yang bias menjadi acuan untuk melihat staging kanker prostat yang paling umum yang dikeluarkan oleh America join committee on cancerdan dikenal TNM system yang mengevaluasi ukuran tumor, tingkat yang terlibat kelenjar getah bening dan setiap metastase.
Tahap I : Ditemukan secara kebetulan seperti hypertrophy jinak
TNM stadium
Evaluasi tumor (T)
TX : tidak bias mengevaluasi tumor utama
TO :Tidak ada bukti tumor
T1 : Tumor ada,tetapi tidak dapat dideteksi dengan pencitraan
T1a :Tumor yang dikebetulan diketemukan dalam waktu kurang dari 5% dar jaringan prostat resectal
T1b : Tumor yang kebetulan ditemukan lebih dari 5% dari jaringan prostat resectal
T1c : Tumor ditemukan pada biopsy dilakukan karena adanya peningkatan PSA
T2 : Tumor dapat dirasakan atau diraba (diperiksa secara fisik )tapi belum meyebar diluar prostat
T2a:Tumor ada setengah atau kurang dari setengahdari salah satu kelenjar prostat dua lobus
T2b:Tumor lebih dari setengah satu lobus,tapi tidak keduanya
T2c:tumor adalah dalam kedua lobus
T3 : Tumor mulai menyebar melalui prostat kapsul
T3a:Tumor mulai menyebar melalui kapsul pada sah satu atau keduasisinya
T3b:Tumor telah menyerang vesica seminalis
T4:Tumor telah menginvasi ke jaringan yang lain
Evaluasi dari kelenjar getah bening (N)
NX : Tidak dapat mengevaluasi kelenjar getah bening regional
NO:Tidak ada penyebaran di getah bening regional
N1:Telah menyebar ke getah bening regional
Evaluasi metastase (M)
MX: Tidak bias mengevaluasi metastase
MO:Tidak ada metastase
M1:PTerdapat metastase jauh
M1a:Kanker telah menyebar ke kelenjar getah bening
M1b:Kanker telah mneyebar ke tulang
M1c:Kanker telah mnetebar ke organ yang lain
Evaluasi hystologi Grade (G)
GX : Tidak bias dinilai
G1:Tumor mirip jaringan normal (Gleason 2-4))
G2:Tumor agak meyerupai jaringan normal (Gleason 5-6)
G3-4:Tumor hamper tidak meyerupai jaringan normal (Gleason 7-10)
Dalam beberpa tahun terakhir patologi jarang menetapkan kelas tumorkurang dari 3.terutama di jaringan biopsy
Gleason 3 +3 : Tumor grade rendah
Gleason 3 +4/3 +5 : Bebrepa grade rendah dengan kelas tinggi
Gleason 4 +3/5 +3:Biasanya grade tinggi dengan kelas rendah
Gleason 4 +4/4 +5/5 +5 :Semua grade tinggi
Langganan:
Postingan (Atom)